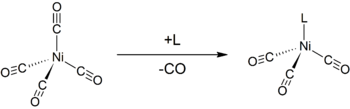Tetrakarbonyl niklu
| Tetrakarbonyl niklu | |
|---|---|

Strukturní vzorec tetrakarbonylu niklu
|
|
| Obecné | |
| Systematický název | tetrakarbonylnikl |
| Triviální název | tetrakarbonyl niklu |
| Ostatní názvy | karbonyl niklu |
| Anglický název | Nickel tetracarbonyl |
| Německý název | Nickeltetracarbonyl |
| Funkční vzorec | Ni(CO)4 |
| Sumární vzorec | NiC4O4 |
| Vzhled | nažloutlá kapalina |
| Identifikace | |
| Registrační číslo CAS | 13463-39-3 |
| EC-no (EINECS/ELINCS/NLP) | 236-669-2 |
| Indexové číslo | 028-001-00-1 |
| PubChem | 26039 |
| ChEBI | 30372 |
| UN kód | 1259 |
| SMILES | C(#O)[Ni](C#O)(C#O)C#O |
| InChI | 1S/4CO.Ni/c4*1-2; |
| Číslo RTECS | QR6300000 |
| Vlastnosti | |
| Molární hmotnost | 170,73 g/mol |
| Teplota tání | -17,2 °C |
| Teplota varu | 42,2 °C |
| Hustota | 1,362 g/cm³ (0 °C) 1,32 g/cm³ (17 °C) 1,310 3 g/cm³ (20 °C) |
| Viskozita | 3,05×10−4 Pa·s |
| Kritická teplota Tk | 193 °C (rozklad) |
| Rozpustnost ve vodě | 0,018 g/100 ml (10 °C) |
| Tlak páry | 17,732 kPa (2 °C) 31,731 kPa (15,3 °C) 42 kPa (20 °C) 59,195 kPa (29,5 °C) 86,259 kPa (40 °C) |
| Měrná magnetická susceptibilita | -6,04×10−6 cm3 g-1 |
| Ionizační energie | 8,28 eV |
| Povrchové napětí | 17,4 mN/m (0 °C) 15,1 mN/m (20 °C) 11,6 mN/m (50 °C) |
| Struktura | |
| Krystalová struktura | krychlová |
| Hrana krystalové mřížky | a= 1 078 pm |
| Koordinační geometrie | tetraedrická |
| Tvar molekuly | tetraedr |
| Dipólový moment | 0 Cm |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | -631,8 kJ/mol (kapalina) -602,91 kJ/mol (plyn) |
| Entalpie tání ΔHt | 81,0 J/g |
| Entalpie varu ΔHv | 174,5 J/g |
| Standardní molární entropie S° | 313,4 J K-1 mol-1 (kapalina) 410 J K-1 mol-1 (plyn) |
| Standardní slučovací Gibbsova energie ΔGf° | -588,3 kJ/mol (kapalina) -587,27 kJ/mol (plyn) |
| Izobarické měrné teplo cp | 1,198 J K-1 g-1 (kapalina) 0,850 4 J K-1 g-1 (kapalina) |
| Bezpečnost | |
| H-věty | H225 H351 H360D H330 H410 |
| R-věty | R61 R11 R26 R40 R50/53 |
| S-věty | S53 S45 S60 S61 |
| NFPA 704 |
 3
4
3
|
| Teplota vzplanutí | -24 °C |
| Teplota vznícení | 60 °C |
| Meze výbušnosti | 2–34 % |
| Není-li uvedeno jinak, jsou použity jednotky SI a STP (25 °C, 100 kPa). |
|
Tetrakarbonyl niklu (též karbonyl niklu; název podle IUPAC: tetrakarbonylnikl) je sloučenina se vzorcem Ni(CO)4. Tato nažloutlá kapalina je velmi těkavá a vysoce toxická. Používá se pro poniklovávání oceli a jiných kovů a pro výrobu velmi čistého niklu. Je meziproduktem v Mondově procesu čištění niklu a reagenciem v organokovové chemii.
Obsah
Struktura a vazby[editovat | editovat zdroj]
Karbonyl niklu má čtyřstěnnou molekulu se čtyřmi karbonylovými ligandy navázanými na atom niklu. Tyto ligandy, ve kterých jsou uhlík a kyslík spojeny trojnou vazbou (často však znázorňovanou jako vazba dvojná), jsou na nikl kovalentně vázány uhlíkovým koncem. Struktura karbonylu niklu a podobných sloučenin mnoho let mátla chemiky a většina publikací před rokem 1950 vyobrazuje řetězce tvořící s kovem chelát.
Karbonyl niklu má 18 valenčních elektronů, podobně jako jiné karbonyly kovů, například pentakarbonyl železa nebo hexakarbonyl molybdenu. Tyto karbonyly mají symetrickou strukturu a jsou elektricky neutrální, což je důvodem jejich vysoké těkavosti. V Ni(CO)4 má atom niklu formální oxidační číslo nulové.
Příprava[editovat | editovat zdroj]
Ni(CO)4 byl proprvé syntetizován Ludwigem Mondem v roce 1890 přímou reakcí kovového niklu s oxidem uhelnatým.[1] Tato průkopnická práce byla předzvěstí existence mnoha jiných kovových karbonylových sloučenin, například vanadu, chromu, manganu, železa nebo kobaltu. Byla též průmyslově využita na konci 19. století k čištění niklu.[2]
V procesu se při 50 °C nechává procházet oxid uhelnatý přes nečistý nikl. Optimální rychlost reakce nastává ale až při 130 °C.[3]
Ni(CO)4 není běžně komerčně dostupný. Obvykle se v laboratoři připravuje karbonylací snadno dostupného bis(cyklooktadien)niklu.
Reakce[editovat | editovat zdroj]
Tepelná dekarbonylace[editovat | editovat zdroj]
Při mírném zahřívání se Ni(CO)4 rozkládá na oxidu uhelnatý a kovový nikl. V kombinaci se snadnou tvorbou tetrakarbonylu niklu z CO a nečistého Ni, je tento rozklad základem Mondova procesu čištění niklu. Rozklad začíná okolo 180 °C a s rostoucí teplotou se zrychluje.[3]
Reakce s nukleofily a redukčními činidly[editovat | editovat zdroj]
Podobně jako jiné nízkovalentní kovové karbonyly, je Ni(CO)4 citlivý na působení nukleofilů. Ty působí na niklové centrum, kde nahrazují karbonylové ligandy, anebo na karbonylech. Donorové ligandy, například trifenylfosfan, reagují za vzniku Ni(CO)3(PPh3) a Ni(CO)2(PPh3)2. Bipyridin a další takové ligandy se chovají podobně.[4] Monosubstituci lze využít k určení Tolmanova elektronového parametru, míry schopnosti donace nebo stažení elektronu pro daný ligand.
Působením hydroxidů vznikají shluky, například [Ni5(CO)12]2− and [Ni6(CO)12]2−. Tyto sloučeniny lze získat také redukcí karbonylu niklu.
Proto reakce Ni(CO)4 s uhlíkovými nukleofily (Nu−) vede na acylderiváty, například [Ni(CO)3C(O)Nu)]−.[5]
Reakce s elektrofily a oxidačními činidly[editovat | editovat zdroj]
Karbonyl niklu může být oxidován. Chlor ho oxiduje na chlorid nikelnatý za uvolnění plynného oxidu uhelnatého. Podobně se chovají i ostatní halogeny. Tato reakce poskytuje možnost snadno odstranit nechtěná množství toxického Ni(CO)4.
Reakce Ni(CO)4 s alkyl- a arylhalogenidy často vede na karbonylované organické sloučeniny. Vinylové halogenidy, například PhCH=CHBr, se při reakci s Ni(CO)4 n následně s methoxidem sodným převádějí na nenasycené estery. Takové reakce pravděpodobně probíhají přes oxidativní adici. Allylhalogenidy poskytují π-allylnikelnaté sloučeniny, například (allyl)2Ni2Cl2:[6]
- 2 Ni(CO)4 + 2 ClCH2CH=CH2 → Ni2(μ-Cl)2(η3-C3H5)2 + 8 CO
Toxikologie a bezpečnost[editovat | editovat zdroj]
Ni(CO)4 je velmi nebezpečný, mnohem nebezpečnější než odpovídá obsahu CO v něm; odráží to účinky niklu, pokud se uvolní v těle. Tetrakarbonyl niklu může způsobit smrtelnou otravu při vstřebání kůží, ještě snadněji však při vdechování, protože je velmi těkavý. Smrtná koncentrace LC50 pro třicetiminutovou expozici se odhaduje na pouhé 3 ppm, koncentrace 30 ppm usmrcuje člověka okamžitě. Některé osoby vystavené parám o koncentraci až 5 ppm popisovaly pach jako zatuchlý nebo připomínající saze, vzhledem k velmi vysoké toxicitě však čichový vjem neposkytuje spolehlivé varování před potenciálně smrtnou expozicí.[7] Historicky se v laboratořích, kde se pracovalo s Ni(CO)4, chovali kanárci, protože jsou na tento jed velmi citliví a poskytovali včasné varování.
Ni(CO)4 je rozpustný v tucích a prochází biologickými membránami. Při inhalaci se u člověka projevuje ospalost, horečka a změny na plicích. Páry mohou způsobovat kašel, dušnost, podráždění až edém plic, tachykardii, cyanózu, bolest hlavy, závratě a slabost. Toxické účinky jsou zřejmě způsobeny jak niklem, tak oxidem uhelnatým, které se z karbonylu niklu uvolňují. Chronická expozice může vést k rakovině plic nebo nosních dutin. Poměrně častá je dermatitida. Ni(CO)4 se považuje za nejnebezpečnější sloučeninu niklu, která se může vyskytnout na pracovištích.
Otrava Ni(CO)4 je charakterizována dvěma fázemi. V první se objevuje bolest hlavy a hrudi, která přetrvává několik hodin, pak se obvykle stav krátce zlepší. Druhou fází je chronická pneumonitida, která začíná typicky po 16 hodinách kašlem, dušností a extrémní únavou. Nejtěžší stav bývá po čtyřech dnech, kdy může dojít k smrti kardiorespiračním nebo ledvinovým selháním. Rekonvalescence je často velmi dlouhá, mnohdy komplikovaná vyčerpaností, depresí a dušností při námaze. Trvalé poškození dýchacího systému nebývá. Karcinogenita Ni(CO)4 je předmětem diskusí.
Páry tetrakarbonylu niklu se mohou samy vznítit. Ve vzduchu se rychle rozkládají, zhruba do minuty.[8]
Reference[editovat | editovat zdroj]
V tomto článku byl použit překlad textu z článku Nickel tetracarbonyl na anglické Wikipedii.
- ↑ "Action of Carbon Monoxide on Nickel"(1890). J. Chem. Soc., Trans. 57: 749–53. doi:.
- ↑ "The Extraction of Nickel from its Ores by the Mond Process"(1898). Nature 59 (1516): 63–64. doi:.
- ↑ a b Lascelles,Keith; Morgan, Lindsay G.; & Nicholls, David (1991). "Nickel Compounds". Ullmann's Encyclopedia of Industrial Chemistry A17 (5): 235–249. doi:.
- ↑ (1992) Organometallics : A Concise Introduction, 2nd, Weinheim: Wiley-VCH. ISBN 3-527-28165-7.
- ↑ EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2003.
- ↑ Semmelhack, M. F.; Helquist, P. M.(1988),"Reaction of Aryl Halides with π-Allylnickel Halides: Methallylbenzene",Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv6p0722; Coll. Vol.6: 722
- ↑ Board on Environmental Studies and Toxicology(2008)."Nickel Carbonyl: Acute Exposure Guideline Levels", Acute Exposure Guideline Levels for Selected Airborne Chemicals: Volume 6. National Academies Press, 213–259.
- ↑ "Nickel Carbonyl: Decomposition in Air and Related Kinetic Studies"(1980). Science 208 (4447): 1029–1031. doi:. PMID 17779026.
Literatura[editovat | editovat zdroj]
- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
- Shi Z (1991). "Nickel carbonyl: toxicity and human health". The Science of the Total Environment 148 (2-3): 293–298. doi:. PMID 8029705.
- Sunderman FW (1989). "A Pilgrimage into the Archive of Nickel Toxicology". Annals of Clinical and Lalboratory Science 19: 1–16.
- Armit HW (1908). "The toxicology of nickel carbonyl. Part II.". Journal of Hygiene 8: 565–610. PMID 20474374.
- Armit HW (1907). "The toxicology of nickel carbonyl". Journal of Hygiene 7 (4): 525–551. doi:. PMID 20474327.
- Barceloux DG (1999). "Nickel". Journal of Toxicology-Clinical Toxicology 37 (2): 239–258. doi:. PMID 10382559. DOI